Dag fire bød på mange faglig relevante temaer. Delir(ium) er ikke noe uvanlig syn hverken på psykiatrisk eller somatiske avdelinger, og det var nyttig å få en oppdatert gjennomgang om dette. Heroin-assistert behandling (HAB) har politisk medvind, så å få et faglig perspektiv var svært nyttig. Tiaminbehandling er strengt nødvendig og farlig å overse hos pasienter som trenger det. Leger i rusbehandling har til nå hatt bakgrunn som psykiatere og i noen tilfeller allmennleger (etter min oppfatning, har ikke data på dette), men det er nå blitt en egen legespesialisering. I dag fikk vi sjansen til å høre mer om dette.
Siden det har blitt meget lange blogginnlegg forsøker jeg nå en ny stil, hvor jeg “kollapser” de aktuelle emnene, slik at man kan åpne det man er interessert i å lese om. Forhåpentligvis blir det da mer oversiktlig.
– Delirium: Vanlig og alvorlig, men ofte oversett
Delirium: Vanlig og alvorlig, men ofte oversett
Først ute var lege Leiv Otto Watne ved OUS og postdoc ved institutt for medisinske basalfag, UiO. Han disputerte nov 2014 på et arbeid om delir hos hoftebruddspasienter (doktoravhandling) og var kommet nå for å snakke generelt om delir på Psykiatriveka. Delir er ikke uvanlig ved somatiske avdelinger, men ofte blir psykiatrisk avdeling kontaktet når pasientene blir urolige, og kanskje ønsker man å flytte de over til oss. Da er det viktig å ha god kunnskap om emnet.
Vi skiller delir inn i undergruppene hyperaktivt, hypoaktivt delir, blandet, subsyndromalt og persisterende. Hyperaktivt delir er lett å se og oppdage (med agitasjon, aggressivitet, hallusinasjoner og vrangforestillinger), mens hypoaktivt delir er vanskeligere (nedsatt reaksjonsevne, treg tale og langsomme motoriske funksjoner/mimikkfattig). Pasienten med hypoaktivt delir er likevel svært plaget, men holder seg i ro. Det er veldig ubehagelig der og da og mange pasienter har i ettertid mer behov for å snakke om forvirringstilstanden sin enn “hjerteinfarktet”.
Han tok opp så at det finnes to vanlige misforståelser:
- Delir kommer bare av alkohol (Feil: delir kommer av mange ting)
- Delir = demens. (Feil: det ene er en akutt tilstand, det andre er en kronisk tilstand)
Hva er delirium og hvor vanlig er det?
DSM-5-kriteriere for delirium:
- Forstyrret oppmerksomhet (f.eks. redusert evne til å styre, holde og endre fokus) og bevissthet (redusert orientering til miljøet rundt seg)
- Rask utvikling (timer til dager), endring, fluktuasjon (særlig på natten; vår lokale medisinsk faglige overlege i Kristiansand påpeker alltid hvordan pasienten alltid er fin når overlegen ser til dem på dagtid)
- Kognisjonsendring (hukommelsesproblemer, desorientering, språkforstyrrelser, persepsjonsforstyrrelser)
- Ekslusjonskrtierie: ikke “bare” demens
- Fysiologisk konsekvens: (indisier på at det skyldes somatiske tilstander); Infeksjon, lårhalsbrudd, hjerteinfarkt, hjerneslag, medikamenter +++
Forekomst: 14-24% ved innleggelse, 6-56% ila sykehusoppholdet, hoftebrudd 35-65%, intensivavdelinger 19-83%, hos terminale pasienter 85-90%, forpasienter med demens får 60-89% diagnose under innleggelse. Hvorfor så stor spredning? Kanskje sammenheng med hvorvidt det oppfattes som delir eller ikke. Jeg fikk ikke helt med meg alle forholdene rundt tallene som Watne her la frem. Han viste til review-artikkelen “Delirium in elderly people” (Inoyue Lancet 2013, pdf) (samt artikkelen “Delirium in patients with cancer”, Breitbart 2012, pubmed). I Inoyues review varierer også tallene ut fra hvilke studier man ser på.
Overses det ofte?
Ryan DJ, BMJ Open 2013 Jan 7;3:
Ved Cork University Hospital, Irland, 407 senger. 15.mai 2010 ble alle inneliggende pasienter undersøkt for delir (“punktprevalens-studie”). 19,6% hadde delir (53% på geriatrisk avdeling). Bare 44% av pasientene hadde delirium dokumentert i journalen.
Risikofaktorer for delir?
Alle kan få delir bare man blir utsatt for stort nok stress, men dess mer sårbar skal det mindre til (f.eks. én dose sovemedisin ved alvorlig demens). Så dette forklarer hvorfor vi har høyest forekomst av delir på sykehus på geriatrisk (høy sårbarhet) og intensivavdeling (høyt stress). (Se illustrasjon i tidsskriftet).
Noen vanlige risikofaktorer er høy alder, kognitiv svikt, depresjon, tidligere gjennomgått delirium, omfattende komorbiditet, sansesvikt, lav kroppsmasse. Vanlige utløstende faktorer er gjerne hoftebrudd, kirurgiske inngrep, infeksjon, hjerneslag, akutt koronarsykdom, dehydrering, metabolske forstyrrelser, smerter, polyfarmasi og sederende medikamenter. (Se oversiktsartikkel fra Tidsskriftet: Neerland, Watne og Wyller 2013)
Delirium eller demens?
| DELIRIUM | DEMENS |
| Brå debut, varer fra timer til mnd | Varer over tid, mer enn 6 mnd |
| Fluktuerende forløp | Stabilt forløp |
| Nedsatt oppmerksomhet | bevart oppmerksomhet (bortsett fra alvorlig demens) |
| Desorganisert tenkning | Redusert tenkning |
Det er nyttig å kunne snakke med pårørende her da hvordan det har utviklet seg er viktig for å skille de to tilstandene.
Hvordan blir delir og demens knyttet sammen?
Witlox, JAMA 2010: Delirium in elderly patients and the risk of postdischarge mortality: Delir gir økt risiko for død, økt risiko for å komme på institusjon, økt risiko for å utvikle demens.
Davis; Brain 2012: Delirium is a strong risk factor for dementia in the oldest-old: a population-based cohort study:
Studien tok utgangspunkt i alle eldre i befolkningen i byen Vanda (eller Vantaa på finsk). De så på utvikling hos dem som har hatt delir og ikke hatt delir mht MMSE-score. En episode med delir var assosiert med en dramatisk økning i risko for demens på neste kontroll (OR 8,7). Delir var også assosiert med forverring av kognitiv funksjon hos pasienter med demens (OR 3,1).
De fikk også tilgang til å se på hjernene til pasientene. Pasienter som hadde demens og ikke delir hadde de klassiske nevropatologiske tegnene på demens, plakk og slikt man finner ved Alzheimers. De pasientene som hadde delirium og demens hadde ikke de samme kjennetegnene.
Andre studier har pekt på det samme (Delirium accelerates cognitive decline in Alzheimers disease, Fong 2009, pubmed)
Han viste så til en annen norsk studie (Krogseth et al 2011, pubmed)
De lagde en prospektiv studie med 6 måneders oppfølging i 2006 med hoftebrudd uten kjent demens og så på forskjeller blant dem som fikk delir under oppholdet og som ikke fikk det:
- de med delir (27%), hadde 37,5% demens etterpå
- de uten delir, hadde 6,5% demens etterpå
- signifikant forskjell: p<0,001
Men var de deliriøse allerede demente? Dette forsøkte de å justere vha opplysninger fra pårørende. Konklusjonen ble at det å ha delir kan føre til en permanent kognitiv svikt hos pasientene.
Forebygging av delirium
Inouye et al 1999: A multicomponent intervention to prevent delirium in hospitalized older patients.
De gjorde en prospektiv studie ved et somatisk sykehus i Boston med tre sengeposter. En av postene var intervensjonsenhet for å forebygge delir, de to andre ga TAU (treatment as usual). De fikk 30% lavere forekomst av delir på intervensjonsposten. Men hva gjorde de? De la vekt på seks risikofaktorer og prøvde å intervenere når nødvendig:
- Kognisjon: De orienterte pasienten hele tiden, sa hvor de var, kalender
- Søvn
- Mobilitet: komme ut tre ganger fra sengen
- Syn: passe på at pasienten hadde sine briller
- Hørsel: passe på at pasienten har høreapparat og ikke ørevoks
- Dehydrering
Noen av disse intervensjonene ble nok gjort i TAU-gruppene også da de samme legene så til pasientene. Men på spesialenhetene hadde de annet helsepersonell som var trent opp spesifikt i dette og de assisterte ikke de andre postene under forsøket.
Behandling av delirium
Kan vi behandle delir med medisiner? Hva skyldes det? Det finnes en del teorier, og han referte bl.a. til artikkelen “Neuropathogenesis of delirium: review of current etiologic theories and common pathways” (Maldonado 2013, pubmed, ClinikalKey). Bare for å vise hvor komplisert dette er viste han oss følgende flytskjema: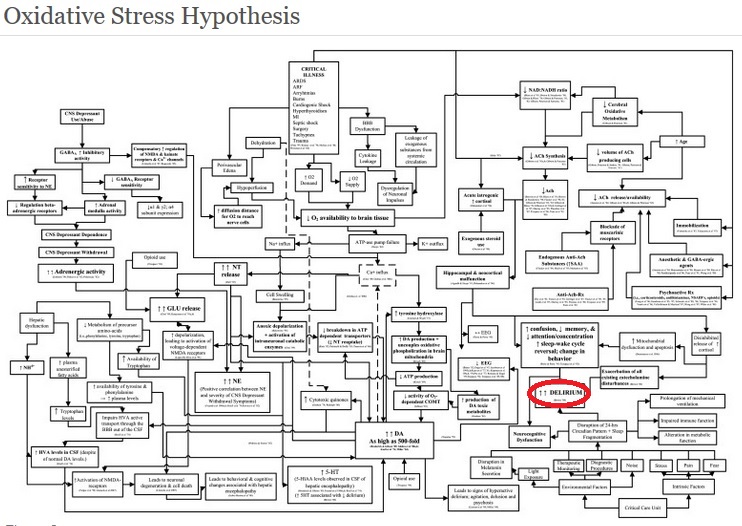
Dette er bare en modell på mulig patofysiologi. Her ender alle til slutt opp i delir som jeg har markert med rødt her.
Watne viste så til endringer av nevrotransmittere under delir: Økt dopamin, opp/ned serotonin, redusert melatonin, redusert acetylcholin, økt noradrenalin. (GABA var også nevnt, men ingen pil opp eller ned.)
Schuckit 2014: “Recognition and management of withdrawal delirium (delirium tremens)”
Alkohol-abstinens kombinert med delirium = delirium tremens, og skal behandles med benzodiazepiner. Ellers skal man ikke behandle delir med benzodiazepiner
Inoye sier at ingen legemidler virker (men lett for henne å si som sitter på et kontor i Boston og aldri ser pasienter): “present evidence do not support the use of antipsychotics for prevention or treatment of delirium” (Inouye 2014, pubmed free fulltext). Andre har lest de samme artiklene og kommet til annen konklusjon: “..early intervention with low-dows treatment for short periods of 1-2 weeks is prudent for many patients.” (Meagher 2013, pubmed, ClinicalKey). Jeg vet ikke hvem som har rett, men sjekker man Cochrane så kan det være at lavdose Haldol kan ha en liten effekt på å redusere varigheten og graden av delir hos postoperative pasienter. Men de konkluderer også med at det trengs flere studier (Lonergan 2007, pubmed).
Han viste så til en studie hvor man sendte ut spørreskjema rundt i Europa og spurte hva de ulike legene brukte som “First line pharmacological management in hyperactive delirium.” (Morandi et al 2013, pubmed free full-text) Når det gjaldt medikamentell behandling var haloperidol mest vanlig (62%) etterfulgt av risperidon (12%), klozapin (5%) og deretter en del andre.
Oppsummering:
- Delirium er vanlig og alvorlig
- Tenk delirium! Diagnosen blir ofte oversett
- Pasienter med demens er spesielt utsatt
- Delirium er (sannsynligvis) en risikofaktor for demens
- Det er ingen effektiv behandling, men delirium kan forebyggest
Per tid er det ennå ikke lagt ut noe kopi av foredraget til Watne, men tidligere foredrag av ham og medarbeidere kan dere finne på nettet:
- Delirium – diagnostikk, behandling og patofysiologi (fra legeforeningen.no)
- Kasuistikker v/Neerland (midt på side 3 er også en bra slide om ikke-medikamentelle tiltak som er nyttig å ta med seg i arbeidet med deliriøse pasienter)
- DELIRIUM – en viktig og utfordrende diagnose – forelesning v/Neerland
- Inflammasjon og delirium – foredrag v/Watne
- Delirium og inflammasjon i de nedre urinveier – masteroppgave v/Armind Semb
– Heroinassistert behandling (HAB) i Norge?
Heroinassistert behandling (HAB) i Norge?
Philipp Lobmaier, PhD og LIS-lege ved SERAF & OUS, Søndre Oslo DPS.
Lobmaier tok opp at han først og fremst forsker på bruk av naltrexon-implantater, men at det var HAB han var blitt bedt om å snakke om her i dag. Dette er ikke bare fag og forskning, men det er også mye politikk i dette. Han viste til at han som første generasjons innvandrer kan ha noe fugleperspektiv. Han påpekte at han heller ikke stemmerett.
Det er politisk uenighet om HAB. I mars 2009 satte helseminister Hansen (Ap) ned et utvalg for å utrede tiltak til de mest vanskeligstilte. I juni 2010 anbefalte Stoltenberg-utvalget i sin rapport 22 tiltak til Helsedepartementet, bl.a. HAB. I april 2015 gjorde Ap et landsmøtevedtak om lokale forsøk på HAB i Bergen og Oslo. (Riktignok med et forbehold som Lobmaier ikke nevnte: “Det må være en medisinsk vurdering som ligger til grunn for hvilke medikamenter som brukes i helsehjelp til rusavhengige som til andre pasientgrupper, ikke en politisk. Oppstart av heroinassistert behandling skal skje i en kontrollert studie.“)
Lobmaier viste så til en rekke uttalelser han hadde plukket opp: “Hab kan nå ut til de tyngste brukerene.” “Hab reduserer sjansen for overdose“. Hva viser tallene? HAB-brukere utgjør 8% (n=1450) av LAR-pasientene i Sveits, 5% (n=745) i Nederland og 3,5%i Danmark. I Norge har vi i dag 7.500 i LAR og tar vi 4-5% som utgangspunkt for målgruppe ville det tilsi 300-375 HAB-pasienter.
Heroin, diamorfin, har kort halveringstid og må derfor injiseres 2-3 ganger daglig (i tillegg til annet substitutt for natten). Det har en overdosefare på 1:6000 injeksjoner og krever derfor alltid tilsyn av helspersonell. Dette i motsetning til f.eks. buprenorfin som sjeldent gir overdose og gis sublingvalt en gang daglig. Å dele ut heroin vil derfor kreve langt mer ressurser fra både helsepersonell, men også den rusavhengige selv som må møte opp tre ganger daglig og derfor bo i nærheten av utdelingsstedet.
LAR-statusrapport per 2014, SERAF, 2/2015, Waal et al.
- 43,4 år i gjennomsnitt, kun 40% som nå får metaodon
- 70% behandles med mål om rusfrihet, derav har 58% oppnåd målet
- 23% behandles for stabilisering (Subuxone)
- 7% hadde ikke-dødelige overdoser siste året
- 9% brukte illegal heroin siste måned
Hvem er de tyngste misbrukerene?
- “Hard-to-treat” er kjent for tiltaksapparatet
- Erfaring med LAR og annen behandling men mangler god nok bedring, non-responder?
- Faller fra uten re-inntak
- “Hard-to-reach” er skjult populasjon
- Marginaliserte, multippel funksjonssvikt – MAS?
- negative, motvillige, men integrert i rusmiljø
- Ønsker forsatt heorin og vil ikke ha noe annet
- avviser kravene i behadlingsprogrammene
- Også naltrekson-kandidater?’
HAB = LAR med diamorfin?
- Ingen diamorfin ta-hjem doser, derfor lang åpningstid 7 dager i uken, alle dager
- Pasienten må komme 2-3 ganger daglig
- Metadondose (opp til 60 mg) på kvelden for å unngå nattlig abstinens
- Må bo i nærheten av behandlingssenteret, maks 30 min unna.
Lobmaier viste så til en review-artikkel (Strang et al 2015) som bl.a. viste at riskoen ved bruk av HAB er langt større enn for metadon, med en RR=4,99 for bivirkninger. (For spesielt interesserte anbefaler jeg å se nærmere på artikkelen selv.)
Heroin-legalisering vs. diamorfofobia:
- HAB i Norge bør vente fordi
- Vivitrol (naltrekson depot) kommer!
- Åpent alle dager er dyrt i Norge (to skift med utdannet helsepersonell)
- LAR kan forbedres
- kvantitativt mot 10.000 i behandling (80%)
- styrke samarbeid med psykisk helsevern
- styrke fastlegekompetansen
- styrke oppsøkende virksomhet.
Til slutt ville Lobmaier understreke at det han egentlig driver med er dette: www.stoppoverdoser.no
– Tiamin-behandling
Tiamin-behandling
 Nevrolog Geir Bråthen ved NTNU/St.Olavs skulle snakke om tiaminbehandling. Målet med foredraget var å forklare hva tiamin er, hvorfor det er viktig, lære oss å gjenkjenne risikopasienter, kjenne til symptomer på akutt tiaminmangel og hvordan behandle dette.
Nevrolog Geir Bråthen ved NTNU/St.Olavs skulle snakke om tiaminbehandling. Målet med foredraget var å forklare hva tiamin er, hvorfor det er viktig, lære oss å gjenkjenne risikopasienter, kjenne til symptomer på akutt tiaminmangel og hvordan behandle dette.
Det er utgitt retningslinje for Wernickes encefalopati som er nyttig å kjenne til: EFNS guidelines for diagnosis, therapy and prevention of Wernicke encephalopathy (pubmed, pdf).
Hva er tiamin?
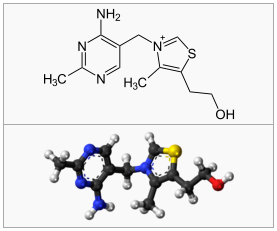 Tiamin er også kjent som vitamin B1. Selve ordet “thio-vitamin” betyr vitamin som inneholder svovel, som man kan se på figuren til høyre.
Tiamin er også kjent som vitamin B1. Selve ordet “thio-vitamin” betyr vitamin som inneholder svovel, som man kan se på figuren til høyre.
I kroppen klarer vi bare å absorbere noen få mg hver dag. Vi forbruker 0,5 mg hver dag. Vi har et lager i kroppen på ca. 30 mg. Alle levende organismer er avhengig av tiamin. Bakterier, sopp og planter produserer det selv, men vi må få det gjennom kosten, hovedsaklig planter. Det suges opp i tynntarmen, må fosforyleseres og så lagres (bl.a. i lever, men også skjelettmuskel, hjerte, hjerne og nyrer).
Hva gjør tiamin?
Tiamin er et koenzym på to steder i sitronsyresyklus. Hvis prosessen stanser opp får ikke cellen energi, det lages toksiske stoffer og cellen dør. De mest metabolsk aktive cellene dør først, deriblant nevronene.
Alkohol hemmer opptaket fra tynntarmen slik at vi ikke tar opp tiamin i kosten, heller ikke gjennom tabletttilskudd. Alkohol reduserer også fosforyliseringen og øker utskillelsen av tiamin. Har man vært hard mot leveren sin kan også lageret være mye mindre enn normalt.
Det er også ikke-alkoholiske årsaker til tiaminmangel. Vi ser f.eks. ernæringssvikt pga en rekke andre sykdommer, særlig kreftsykdommer, etter abdominal kirurgi (fedmekirurgi!), etter tilstander med langvarig oppkast (Galvin et al 2010).
Tiaminmangelsykdommene
Tradisjonelt snakket vi om sykdommen beriberi som samlet det meste av tiaminmangelsykdommer, men som vi ikke bruker i dag. Beriberi var vanlig på steder hvor polert eller hvit ris utgjorde en viktig del av kosten (da fjerner man en viktig tiaminkilde).
Wernickes encefalopati er en akutt/subakutt iskemi i energikrevende hjerneregioner, særlig i hypothalamus, PAG, mediale thalamus, vermis anterior. Nevroner dør; petekkiale småblødninger. Dette er underdiagnostisert, i autopsimaterialer er det en prevalens på 1-2% og bare 32% av disse ble diagnostiert.
Korsakoffs syndrom er psykiatriske symptomer som henger ved Wernickes encefalopati, men kan også oppstå isolert dersom det oppstår kortikale lesjoner i thalamus(?). DMS-IV-kriteriene er: 1) anterograd amnesi, 2) varierende grad av retrograd amnesi, 3) en av følgende: afasi, apraksi, agnosi, svikt i eksekutive funksjoner. Konfabulering står ikke i denne listen selv om det er et kjent symptom.
Korsakoff opptrer samtidig med eller i senere fase av Wernickes encefalopati. Korsakoff viser at encefalopatien har gått langt, de er mer resistent mot tiaminbehandling og bare 20% oppnår normalisert kognisjon. Den eneste “fordelen” er at den alkoholoppsøkende atferden opphører, men da er det kanskje allerede for sent.
Wernickes encefalopati ser man på MR ved økt kontrastoppladning i corpus mamillare og mediale thalamus bilateralt, særlig hos alkoholikere (se Zuccoli et al 2009 og radiopaedia.org).
Vi kan ikke bruke triaden (1.forstyrrelse i øyemotilitet, 2.mentale forstyrrelser (konfusjon, redusert våkenhet), 3.ataksi) til å sette diagnose, for da mister vi en del av tilfellene. De har foreslått nye kriterier for diagnostikk av Wernicke (-Korsakoff) i artikkelen sin:
- Holdepunkter for ernæringssvikt
- Oftalmoplegi. Enhver forstyrrelse i øyebevegelser. Nystagmus er hyppigst (deretter abducens-parese(?))
- Cerebellær dysfunksjon; ustøhet/gangataksi er vanligst
- Kognitiv påvirkning (amnesi, apati)
Minst to av fire tegn gir en sensitivitet på 85%. Falske positive er et mindre problem da behandling med tiamin er trygt. (Gi heller tiamin 10 ganger for ofte enn en gang for lite [min kommentar].)
Det er bare én artikkel som fyller kriteriene for å bli med i Cochrane-undersøkelse. Cochrane (Day et al 2004) fant følgende RCT: Ambrose et al 2001: mulig dose-effekt: 200 mg bedre enn 5 mg.
Er tiamin et trygt preparat? Det er noen anekdotiske beskrivelser av hjertestans og anafylaksi etter tiamin-dosering, men kan peke på at det er andre ting enn tiamin som er årsaken. Forsøk med 989 pasienter (Wrenn et al 1989) som ga 100 mg rask i.v. bolus og 11 fikk forbigående lokal irritasjon og 1 generalisert kløe.
Litt common sense:
- halveringstid på 96 minutter – bør doseres x 2-3 (Tallaksen et al 1991)
- Det er nødvendig å behandle i flere dager før det blir målbart tiaminnivå i spinalvæsken
[Han hadde et par punkter til her, men de fikk jeg ikke med meg.]
Før vi gir tiamin, ta blodprøve til tiaminbestemmelse. I det øyeblikket vi har gitt tiamin har vi ikke mulighet for å finne ut hvordan nivået var.
Alle pasienter som misbruker alkohol og legges inn på sykehus skal ha tiaminprofylakse, (50-)100 mg i.m. daglig i minimum 3 dager eller til utskrivelse. Tabletter anbefales etter utskrivelse til tross for at alkohol hemmer opptak.
Ved mistanke om alvorlig Wernickes encefalopati med nedsatt bevissthet er det viktig at du ikke begynner å gi akuttpasienten glukose. Du må gi tiamin først før du gir glukose, for gir du glukose først kan du tømme de allerede slunkne tiaminlagrene og gjøre situasjonen verre. I mange land tilsetter de tiamin i glukoseinfusjon, men ikke i Norge, så her bør vi kanskje gjøre en endring. Anbefalt behandling er 500 mg i.v. initialt, og deretter 200 mg x 3 i.v. i flere dager. (Se også retningslinjer i nevroNEL.)
– Presentasjon av den nye spesialiteten i rusmedisin
Presentasjon av den nye spesialiteten i rusmedisin
Rusbehandling har gått fra å være sosialtjeneste til å bli en spesialisthelsetjeneste og ble overført fra fylkeskomunene til de regionale helseforetakene fra 1.januar 2004. Tidligere hadde ikke leger en gang henvisningsrett. Nå har vi leger en sentral rolle i behandlingen. Det har vært en bekymring at behandlingen ikke har vært optimal, ikke vitenskapelig dokumentert og det har vært et ønske om mer spisset kompetanse (se Dnlf-rapport, “På helsa løs” fra 2006, pdf-versjon).
Rune Tore Strøm er leder av spesialitetskomiteen i rus-og avhengighetsmedisin, og jobber ved OUS. Han kom og snakket om den nye spesialiteten i rusmedisin. I 2006 ble den gamle rusforeningen organisert i Norsk forening for Rus- og avhengighetsmedisin (NFRAMs nettside). De har gått fra å være en spesialforening til å bli en egen fagmedisinsk forening med egen spesialitet. De sendte inn anmodning til HOD i 2009 og tre år og tre måneder senere fikk de svar. De skulle lage en ny legespesialitet.
Oppdraget fra HOD var at man skulle utdanne leger som kompetente behandlere for pasienter med rus- og avhengighetsproblematikk. De skulle også kunne brukes i TSB og opp mot andre grener i spesialisthelsetjenesten og kommunehelsetjenesten. Etter høringsrunde kom det klare regler til utdanning: 3,5 år i TSB (1 år avgiftning/akutt, 1/2 år døgnbehandling, 1 år poliklinikk, 1 år valgfri TSB, 1 år psykiatri og 1/2 år valgfri tjeneste). De skal ha innføringskurs, inkl. obligatoriske emnekurs i psykiatri. Strøm tenkte på hvordan han tok sin spesialistutdanning i psykiatri og tok utgangspunkt i det, f.eks. det med interundervisning 2 timer per uke i motsetning til en del andre grener som har en gang i måneden.
De skal ha terapiveiledning i 30 timer ila TSB-tjenesten, og aktuelle retninger er KAT, dynamisk (?), gruppeterapi og motiverende intervju (MI). Litt diskusjon rundt om MI er en terapi-metode eller en samtaleteknikk.
Han redegjorde så for kunnskapskravene. Viktige temaer er bl.a. rusmidlenes farmakologi, det nevrobiologiske grunnlaget, betydning av tidligere belastninger/samvariasjon og følgetilstander (ca. 60 ulike relevante somatiske diagnoser som de må kunne fange opp), psykososiale forhold (de prøver å fronte det biopsykososiale perspektivet, tilknytning og rus i familie, rus og følger av det på jobben mm.), forebygging, behandling og rehabilitering (lege-pasientforhold i rusbehandlig, tidlig intervensjon, ulike metoder og kunnskapsgrunnlaget, MI, LAR, ulike livsfaser, kjønn, ROP), brukermedvirkning og empowerment, rammeverk (lovverk, bruk av tvang, meldeplikt, pasientrettigheter), diagnostikk, krav til holdninger, samarbeid med psykiatrien (en del overlappende pasienter).
Psykiatrien og rusmedisinen må ha en del felles målbeskrivelser; eks. voldsrisikovurderinger, selvmordsrisikovurderinger, ADHD, utviklingsforstyrrelser, tilknytningsforstyrrelser, traumer/PTSD, psykosevurderinger, nevrobiologi, farmakologi. Rusmedisin er et eget fagfelt, og det skal ikke bli mindre eget av å samarbeide godt med andre.
– Rusmiddeltesting - hvordan gjøre det rett
Rusmiddeltesting – hvordan gjøre det rett
 Overlege og PhD-stipendiat Andreas Westin ved avd. for klinisk farmakologi ved St.Olavs/NTNU kom og snakket om rusmiddeltesting og hvordan gjøre det på rett måte. Det er veldig mange måter man kan gjøre det feil på. Den viktigste slide’n han viste var derfor en med telefonnummeret til vakthavende farmakolog på St.Olavs. Er man i tvil, så er det bare å ringe. (Jeg velger å ikke legge ut nummeret på bloggen, men ringer du til St.Olavs’ sentralbord på 06800 og ber om å få snakke med vakthavende farmakolog så blir du nok satt over.)
Overlege og PhD-stipendiat Andreas Westin ved avd. for klinisk farmakologi ved St.Olavs/NTNU kom og snakket om rusmiddeltesting og hvordan gjøre det på rett måte. Det er veldig mange måter man kan gjøre det feil på. Den viktigste slide’n han viste var derfor en med telefonnummeret til vakthavende farmakolog på St.Olavs. Er man i tvil, så er det bare å ringe. (Jeg velger å ikke legge ut nummeret på bloggen, men ringer du til St.Olavs’ sentralbord på 06800 og ber om å få snakke med vakthavende farmakolog så blir du nok satt over.)
I løpet av et år analyserer de ca:
- 40.000 rusmiddelprøver
- 30.000 legemiddelprøver
- 200 obduksjonssaker (rettstoksikologi)
- noen få håranalyser
Han viste til “Prosedyrer for rusmiddeltesting IS 2231“. Denne handler først og fremst om sanksjonære prøver. De skiller mellom prøver som kan gi alvorlige sanksjoner og ikke-sanksjonære prøver. Eksempler på alvorlige sanksjoner er tap av jobb, tap av behandlingstilbud, tap av omsorg for barn. Førerkort regnes derimot ikke som en alvorlig sanksjon, men likestilles med andre medisinske prøver, som f.eks. det å kontrollere synet. Det er veldig mange krav i veilederen mht sanksjonære prøver. Når det står “skal” og “må” i veilederen skal man ha veldig god begrunnelse for å avvike dette.
Prinsipper for påvisning
De skiller her mellom spesifikke og uspesifikke tester.
- Immunologiske analysemetoder (raske, lette, uspesifikke – ikke mulighet for alvorlige sanksjoner)
- hurtigtest
- semikvantative
- Kromotografiske analysemetoder (høy presisjon, spesifikk – mulighet for alvorlige sanksjoner)
- tar utgangspunkt i helt kjemiske prøver
Valg av prøvemateriale
Blod, urin, hår og spytt er vanligst, men det meste kan i teorien testes. Et eksempel på mer sjeldne tester er test for morfin i barnebek.
Hva som er best prøvemateriale er avhengig av situasjonen:
- Er man påvirket her og nå er oftest blod (helst CSF) det beste materialet og det brukes f.eks. ved bilkjøring og kriminalitet. Måling av konsentrasjon i urin av morfin sier ingenting om størrelsen på inntaket.
- Lurer man på om pasienten har hatt inntak siden sist gang? Da er urinprøve mest aktuelt. Lurer man på om det har vært inntak i det hele tatt er hårprøve aktuelt. Det er bare St.Olavs og FHI som utfører håranalyse. Dette kan være aktuelt f.eks. ved ADHD og man skal vise at man har vært ren i lengre tid før oppstart med sentralstimulerende legemidler.
Er det kun ett inntak (f.eks. hvis man ble dopet ned) kan det være for lite til å gi treff på prøver.
Et minus med hårprøver er at man ikke sjekker for alkohol og cannabis. Prisen på en hårprøve tilsvarer omtrent en basis urinpakke ganget med antall hårsegmenter som undersøkes.
 Håret vokser med en jevn hastighet. Ved å dele inn i segmenter på ca 1-1,5 cm (jeg husker ikke de nøyaktige tallene han oppga her) så kan man se på en måned om gangen, evt. lengre intervaller for to måneder om gangen.
Håret vokser med en jevn hastighet. Ved å dele inn i segmenter på ca 1-1,5 cm (jeg husker ikke de nøyaktige tallene han oppga her) så kan man se på en måned om gangen, evt. lengre intervaller for to måneder om gangen.
For å utelukke falske positive prøver (f.eks. at man har fått noe i håret uten å ha inntatt stoffet) sammenlignes hårprøven med vaskevannet. Det finnes også noen sjeldne tilfeller av aksial transport som kan gi svar om flere inntak enn det som er tilfellet.
Hvor lenge kan rusmidler påvises i urin?
Det er mange faktorer som spiller inn her, men fettløselige rusmidler (cannabis, diazepam) som er brukt over lang tid kan sitte lenge i. Men han understreket at cannabis sitter likevel ikke lenger i enn 3 måneder (positiv test tyder da på nytt inntak). Påvisningstiden er også påvirket av metoden som benyttes; dess mer sensitiv metode, dess lengre påvisningstid.
Hvor ofte skal man ta prøver?
Dette er helt avhengig av hvor sikre vi er nødt til å være. Ofte er det nok med et par urinprøver i uken. Fortrinnsvis mandag og torsdag, da mandag er nærmest mulig helgen.
Alkohol
Alkohol kan i sjeldne tilfeller tilkomme falskt positiv som resultat av gjæring på legekontoret. Etylglukuronid (EtG) og etylsulfat (EtS) er derfor viktigere å måle enn alkohol (disse blir en del steder ikke tatt som standard, så på jobben min på psyk.avd. pleier jeg å spesifisere at man i det minste også skriver EtG på rekvisisjonen).
CDT har vært en vanlig blodprøve ved mistanke om alkoholmisbruk. Fosfatidyletanol, PEth, tilbys nå og vil etterhvert erstatte CDT. Det er en prøve fra fullblod. (Se også skriv fra St.Olavs om alkoholmarkører).
Et par siste punkter:
Kan man påvise designer-drugs? Svaret er ja, hvis man spør om det. Man finner bare det man leter etter, så hvis man har mistanke må man angi det på rekvisisjonen.
Er det mulig å manipulere? Svaret er ja. Den sikreste måten er å bruke kateter og sette ren urin i sin egen blære. Da kan man avlegge en observert urinprøve og likevel være helt ren. Men du skal være veldig dedikert hvis du gjør dette to ganger i uken for å lure systemet.
– Delirium workshop
Delirium workshop
Etter lunsj var det igjen parallelle sesjoner, og jeg valgte her sesjonen om delir og hodeskader. Andre alternativer var workshop i Motiverende Intervju (MI), pakkeforløp i psykiatrien og temaet “nye rusmidler”. Jeg kunne godt tenkt meg å vært på de andre sesjonene også, men når man først må velge tok jeg det som jeg vurderte som mest nyttig i jobben min.
Sesjonen om delir hadde tittelen “DELIRIUM: DIAGNOSTIKK OG BEHANDLING. KASUISTIKKVERKSTED MED PRAKTISK TRENING I SCREENINGVERKTØY” og var delt i tre foredrag.
Første time var “Delirium: Kasuistikkverksted med praktisk trening i screeningverktøy” hvor postdoc Leiv Ove Watne (som holdt plenumfordrag tidligere i dag) gikk mer inn på diagnostikken og bruk av screeningverktøy. De fleste leger er flinke til å skille mellom akutt og kronisk organsvikt, men kanskje ikke alltid når det gjelder hjernen (delir vs. demens). Delir utvikler seg raskere og fluktuerer i motsetning til demens.
Det er viktig å tenke på delir-diagnosen da den ofte blir oversett og derfor underdiagnostisert. Det har vært noen endringer i kriteriene mellom DSM-IV og DMS-5:
| DSM-5 | DSM-IV |
| A. A disturbance in attention (i.e., reduced ability to direct, focus, sustain, and shift attention) andawareness (reduced orientation to the environment). | A. Disturbance of consciousness (i.e., reduced clarity of awareness of the environment) with reduced ability to focus, sustain or shift attention. |
| B. The disturbance develops over a short period of time (usually hours to a few days), represents a change from baseline attention and awareness, and tends to fluctuate in severity during the course of a day. | C. The disturbance develops over a short period of time (usually hours to days) and tends to fluctuate during the course of the day |
| C. An additional disturbance in cognition (e.g. memory deficit, disorientation, language, visuospatial ability, or perception). D. The disturbances in Criteria A and C are not better explained by a pre-existing, established or evolving neurocognitive disorder and do not occur in the context of a severely reduced level of arousal, such as coma. |
B. A change in cognition or the development of a perceptual disturbance that is not better accounted for by a pre-existing, established or evolving dementia. |
| E. There is evidence from the history, physical examination or laboratory findings that the disturbance is a direct physiological consequence of another medical condition, substance intoxication or withdrawal, or exposure to a toxin, or is due to multiple etiologies. | D. There is evidence from the history, physical examination or laboratory findings that the disturbance is caused by the direct physiological consequences of a general medical condition. |
Se også artikkel (Meagher et al 2014) som sammenligner samsvaret i diagnostiseringen mellom DSM-IV- og DSM-5-kriteriene.
Watne gikk så gjennom en del screeningverktøy for demens. Et av de mest brukte er Confusion assessment method (CAM) (Inouye S Ann Intern Med 1990, pubmed). Det skal ifølge Prof. Inouye gå veldig raskt, men i praksis tar det lengre tid og ikke like bra sensitivitet/spesifitet som i studien hennes. For å stille diagnosen delirium må trinn 1 og 2 samt enten trinn 3 eller trinn 4 være oppfylt:
- Akutt debut og vekslende forløp (viktig å snakke med pårørende)
- Uoppmerksomhet
- Be pasienten ta en tallrekke forlengs og baklengs
- Hvis intubert; be de klemme hånden hver gang du sier bokstaven A
- Det er forsøk på en mobilapp, “DelApp” man kan bruke i fremtiden.
- Desorganisert tankegang
- Kan en sten flyte? Er det fisk i havet?
- Endret bevissthetsnivå
Se også samme liste på nevroNEL med flere eksempler.
Det finnes også tester som ser på alvorlighetsgraden av delir, bl.a. MDAS, men dette brukes helst i forskning. RASS kan brukes til å score bevissthetsnivå.
Det er et nytt screeningverktøy, 4AT, som nylig ble omtalt i Tidsskriftet (Evensen et al 2016). Det er lettere å bruke enn CAM og går veldig raskt. På slutten av timen gikk vi gjennom et par kasuistikker som vi scorte med både CAM og 4AT. Flere i salen ytret at CAM virket enklere, men Watne påpekte at for folk uten opplæring er det lettere å ta i bruk 4AT.
Flere tester finner du på norskgeriatri.no.
Delirium: diagnostikk og behandling
I andre (og tredje) time i “workshoppen” var det prof. Jon Johnsen som foreleste. Jeg har fått gleden av høre på Johnsen mange ganger tidligere og han foreleser om en lang rekke ulike emner (se f.eks. youtube-video om diagnostikk av ROP). Johnsen hadde som vanlig veldig mye på hjertet og jeg klarte ikke å få med meg halvparten. Han vil sende ut foredraget på epost hvis det ikke blir lagt på psykiatriveka.no, men inntil får dere klare dere med det jeg klarte å skrible ned i notatboken min. Jeg beklager at det blir noe stikkordsmessig her. Feil kan også forekomme som i alle skriveriene mine fra psykiatriveka.
Vi behandler ingen pasienter likt. Det er ulike bilder. Det kommer også frem mange nevrologiske symptomer. Når “hjernen er dårlig” kommer det frem flere primitive reflekser. Han pleier som regel å undersøke glabellar-refleksen (tapper på pannen til pasienten (youtube-demonstrasjon) og skal da normalt ikke blinke) og han sjekker også primitive leppereflekser (han strøk f.eks. en pasient på kinnet som så snudde seg og prøvde å suge).
Det er stor forskjell på delir uten demens og delir ved demens som igjen er ulikt ved Parkinsonsdemens og Lewy-legemedemens. Hvis det er et rusmiddeldelir skal pasienten ha en oppmerksomhetssvikt (f.eks. problemer med tallrekke baklengs) og en kognitiv svikt.
Vi har ikke harde facts på hva delir skyldes. En av teoriene er oksygendeprivasjonshypotesen. Hvis det blir en relativ mangel på oksygen i hjernen får nevronene problemer. Sykdommer som øker oksygenbehovet i hjernen eller reduserer oksygenet i hjernen vil derfor lett kunne forklares som bakenforliggende årsaker. Vi får frisetting av dopamin subkortikalt som kan gi karspasmer og vi får så en forsterkende effekt. Vi får hypoaktive GABAerge nevroner grunnet NMDA-reseptor hypoaktivitet. Rusmidler frisetter store mengder dopamin og NA som sekundært nedregulerer ACh.
Den etiologiske modell – nevrotransmitter-hypotesen – tar utgangspunkt i at når vi får en cerebral hypoksi oppstår det en endring i konsentrasjonen av nevrotransmittere. Når vi mister ACh så får vi en kognitiv svikt. Økt nivå av dopamin, NA og glutamat kan gi agitasjon og psykose. Andre transmittere som endres er serotonin, histamin og GABA, men dette avhengig av hjerneområde (Maldonado 2008, pubmed).
Skal vi behandle med antipsykotika er det viktig at vi ikke gir noe med antikolinerg effekt. Alle legemidler med antikolinerg effekt bør vurderes å ta bort. Johnsen har en egen liste som han ser på når han går gjennom medikamentlisten til pasienten. (Nå har ikke jeg listen til Johnsen, men denne ser grei ut.)
Cytokiner kan også utløse delir eller det stimulerer utskillelsen av monoaminer. Alle infeksjoner må adresseres og vi må få opp oksygentilførselen til hjernen igjen.
“Neural network functional connectivity during and after an episode of delirium.” (Choi et al 2012, pubmed, artikkel). Thalamus skal hindre at det kommer for mye stimuli opp til cortex, men når denne er skadet klarer den ikke å stanse alle signalene, det thalamiske filteret virker ikke (om thalamisk filter: lettfattelig artikkel, tung artikkel).
Alle vaskulære skader i hjernen disponerer for lite oksygen.
Det viktigste vi gjør er å sette diagnosen, så må man få oversikt og ha basisinformasjon. Når pasienten holder på å rive ned skjermingsenheten så kan man ikke behandle den underliggende tilstanden, men må først roe ned pasienten. Så kan vi heller gå løs på utløsende årsak. Psykose er veldig vanlig ved delir og da er det viktig å gi antipsykotika. Beltelegging øker risiko for delir med 3,2 x ifølge Inouye.
En huskeregel for underliggende sykdom er “I WATCH DEATH”, Infection, Withdrawal, Acute metabolic, Trauma, CNS pathology, Hypoxia, Deficiences, Endocrinopathies, Acute vascular, Toxins or drugs, Heavy Metals. Detaljene for denne huskereglen (hva de ulike punktene innebærer) og andre vanlige huskeregler for delir finner du her.
Hypo- og hyperaktivt delir skal ha to ulike tilnærminger. (Jeg tar forbehold om at jeg kan ha notert feil mht legemiddeldoser her!) Hyperaktivt delir – Haldol 5 mg eller mindre/døgn hos eldre, yngre ikke mer enn 20 mg/døgn. Obs Lewy-legeme demens (en helt annen situasjon), QTc-tid, hypotyreose. Ved hypoaktivt delir 0,25-1,0 mg/døgn med Haldol.
H2A-regelen angir omtrent dobbelt så mye Haldol (haloperidol) som Ativan (lorazepam). De har omtrent samme halveringstid. (Obs det er noe antikolinerg effekt av lorazepam, selv om den er liten.)
Mindre GABA gir mer dopamin, mer GABA gir mindre dopamin.
Hvorfor velge Haldol? Det har lite respirasjonssenkende egenskaper, lite levertoksisk metabolisme som stort sett går greit. Man begynner med flere doseringer daglig, og når man trapper ned beholder man kveldsdosen.
Heminevrin er Johnsen ikke noe glad i. Det er supertoksisk og veldig vanskelig å dosere. Det er ingen vitenskapelig dokumentasjon på at det har noen god effekt. (Takke seg til at det jobbes med å endre på retningslinjene ved SSHF.)
På slutten av denne timen nevnte han melatonin. Han hadde nylig vært på et ukeskurs om melatonin-fysiologi og selv om det var spennende var dette noe han trengte mer tid på å sette seg inn i. Ramelteon (medscape, wikipedia) er en melatonin-reseptoragonist (ikke markedsført i Norge) som kan være aktuell. Fremtiden får vise.
Psykiatriske sykdommer etter traumatiske hodeskader
Tredje time var det også Johnson som stod for. Noen ganger tenker jeg det ikke er grenser for hvilke temaer den mannen leser seg opp på, men det er tydeligvis ikke første gangen han snakker om dette emnet.
Først hadde han en kommentar til selve tittelen på det han skulle snakke om. Vi bør ikke bruke begrepet “traumatisk hodeskade”, men heller “traumatisk hjerneskade”. Nevrologene har med 20% av hjernen å gjøre (motorikken), mens psykiaterene har med 80% å gjøre.
Også i denne forelesningen hadde han mye på hjertet, og det var såpass sent på dagen at jeg ikke orket å notere meg alt (vi får vente på kopi av powerpointen). Noen få punkter fikk jeg likevel med meg:
Har man hatt hodeskade for lenge siden kan det likevel være mulig å påvise hemosiderin ved MR (særlig med “gradient echo sequences“). Da kan man oppdage gamle ting som lett blir oversett ved CT (se medscape, radiopaedia).
Diffus aksonal skade kan dukke opp i psykiatrisk avdeling og GCS er ikke god til å oppdage dette.
Johnsen advarte mot å fortelle for mye skremmende fra en ulykke hvor en pasient har hatt bevissthetstap. “Amygdala” kan sitte igjen med bruddstykker, og da kan vi risikere å påføre pasienten en PTSD.
Han viste et pasientkasus med to korte alleler for SERT som ikke hadde effekt av SSRI. Han ga ECT, men pga. skade måtte han være forsiktig, og brukte unilateral på motsatt side av skaden med laveste strømstyrke som ga kramper 4-6 ganger. Gir man mer vil ECT forverre den kognitive svikten.
– Konsert med Erlend Ropstad
Etter en lang dag med mye faglig innhold var det konsert for Psykiatrivekas deltagere på Rockheim som lå like ved siden av konferansehotellet. Jeg har ikke noe særlig tidligere kjennskap til venndølen Erlend Ropstad, men han leverte en meget bra konsert og spilte i over en time og klarte å underholde et voksent og relativt edruelig publikum.

